Anorgaaniline Keemia/Redoksreaktsioonid

Redoksreaktsioon on reaktsioon, mille käigus toimub elektronide ülekanne ühelt osakeselt teisele. Redutseerimiseks nimetatakse elektronide liitmise protsessi ning oksüdeerumiseks nimetatakse elektronide loovutamise protsessi. Osake, mis loovutab elektrone on redutseerija ning osake, mis liidab elektrone on oksüdeerija. Oksüdatsiooniprotsessi käigus osakese oksüdatsiooniaste kasvab ehk muutub positiivsemaks, redutseerumisprotsessi käigus osakese oksüdatsiooniaste kahaneb ehk muutub negatiivsemaks.[1]
Redoksreaktsiooni võib väljendada summaarse reaktsioonivõrrandiga: , millest saab eristada poolreaktsioone ehk redutseerumist ja oksüdeerumist . Sageli esitatakse mõlemad poolreaktsioonid redutseerumisreaktsioonidena, antud juhul ja . Poolreaktsiooni oksüdeeritud ja redutseeritud osakesed moodustavad redokspaari. Redokspaaris märgitakse oksüdeeritud vorm enne redutseeritud vormi. Antud reaktsiooni korral on redokspaarideks ja .
Standardpotentsiaal
[muuda]Reaktsiooni spontaansuse termodünaamiline kriteerium on negatiivne Gibbsi energia muut, , etteantud temperatuuri ja rõhu juures. Tavaliselt kasutatakse reaktsiooni standartset Gibbsi energiat (standardsete tingimuste juures), . See suurus on seotud tasakaalukonstandiga :
Kuna summaarne keemiline reaktsioon on kahe poolreaktsioonide vahe, reaktsiooni standardne Gibbsi energia on kahe pool-reaktsioonide Gibbsi energiate vahe. Vesiniku ioonide redutseerimise reaktsioon on valitud reaktsiooniks, mille kõikide temperatuuride juures.
Reaktsiooni standardne Gibbsi energia võib olla mõõdetud galvaanilise raku abil, mis on elektrokeemiline rakk, kus keemilist reaktsiooni on kasutatud elektrilise pinge genereerimiseks. Katood on elektrood, kus toimub redutseerimine, anoodil – oksüdeerimine. Tingimused elektrokeemilise raku jaoks võivad erineda. Tänapäeval kasutakse ühikaktiivsus iga komponendi jaoks, 105 Pa rõhk iga gaasilise komponendi jaoks ning temperatuuriks 298,15 K.
Kui elektrokeemiline rakk, koostatud vesinikelektroodist ja uuritavast elektroodist on standardsete tingimuste all, siis antud rakupotentsiaalide vahet nimetatakse elektroodi standardpotentsiaaliks. Selle väärtust võib teisendada reaktsiooni Gibbsi energiaks:
,
kus on elektronide ülemineku stöhhiomeetriline koefitsient ja on Faraday arv.
Paari standardne potentsiaal on null () iga temperatuuri juures. Reaktsiooni jaoks . tsingi ja vesiniku summaarse reaktsiooni jaoks on kahe redutseerimisreaktsiooni standardsete potentsiaalide vahe . Reaktsioon on soodne ( ja ), kui vastava raku standardne potentsiaal on positiivne. Seega tsink redutseerib H+ ioone standardsete tingimuste all.
Termodünaamika
[muuda]

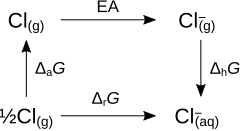
ja oksüdeerumise ning redutseerumise termodünaamilised tsüklid saab kasutada absoluutse elektroodipotentsiaali arvutamiseks (). Vesiniku puhul ja selle abil saab väljundada kõike teiste elementide standardpotentsiaalid kui .
arvutamiseks avaldame metalliooni redutseerimise poolreaktsioon kolmel etapina:
- dehüdratatsioon ()
- deionisatsioon ()
- deatomisatsioon ()
Ignoreerime entroopiat ja avaldame standardpotentsiaali kolme etappide entalpia muutude summana:
.
vs graafik näitab tugeva korrelatsiooni.[2]
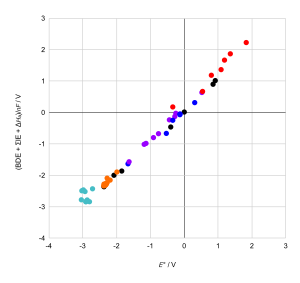
Oletades, et olulisemaks sammuks on ionisatsioon ning lähendades IE elektronegatiivsusega saame tunduvalt nõrgema korrelatsiooni. See tähendab, et elementide elektrokeemia omapärasused on põhjustatud mitmete teguritega nagu: ioonilaeng, iooniraadius, elektronkonfiguratsioon, sidemeenergia, ionisatsioonienergia.
Cs+/Cs ja Li+/Li paar
[muuda]Standardse potentsiaali väärtuste muutus perioodilisustabeli esimeses rühmas tundub vastupidine sellele, mida võiks oodata elektronegatiivsuse väärtustest. Tseesiumil Cs+/Cs (χ = 0,79, E° = 2,94 V) on vähem negatiivne standardpotentsiaal kui liitiumil Li+/Li (χ = 0,98, E° = −3,04 V), vaatamata sellele, et liitiumil on kõrgem elektronegatiivsus. Liitiumi sublimatsiooni entalpia (ΔsH = 171 kJ/mol) ja ionisatsioonienergia (IE = 526 kJ/mol) on kõrgemad kui Cs (ΔsH = 79 kJ/mol, IE = 382 kJ/mol) ja eraldi see viiks rohkem negatiivsele standardpotentsiaalile, kuna iooni moodustamine on vähem soodne. Aga Li-ioonil on tunduvalt negatiivsem hüdratatsiooni energia (ΔhH(Li) = −520 kJ/mol vs ΔhH(Cs) = −264 kJ/mol) selle väikesma raadiuse tõttu (r(Li+) = 90 pm vs r(Cs+) = 181 pm), mis põhjustab tugevaid elektrostaatilisi interaktsioone vee molekulidega. Soodne Li hüdratatsiooni entalpia kaalub üle suurused, mis on seotud Li+ muudustamisega ja viib negatiivsemale standardse potentsiaalile.
Na+/Na ja Ag+/Ag paar
[muuda]Na (E°(Na+/Na) = −2,71 V) ja Ag (E°(Ag+/Ag) = +0,80 V) puhul on vastupidi, suuremat rolli mängivad teised suurused. Ioonide 6-koordinatiivsed raadiused on väga sarnased (r(Na) = 102 pm ja r(Ag) = 115 pm) ja järelikult ioonide hüdratatsiooni entalpia väärtused on ka sarnased (ΔhH(Na) = −406 kJ/mol and ΔhH(Ag) = −468 kJ/mol). Aga palju kõrgema sublimatsiooni entalpia (ΔsH(Na) = 109 kJ/mol vs ΔsH(Ag) = 284 kJ/mol) ja ionisatsioonienergia (IE(Na) = 502 kJ/mol vs IE(Ag) = 735 kJ/mol) tõttu on hõbeda standardpotentsiaal on positiivsem. Kõrgemad väärtused on põhjustatud 4d elektronide nergemat varjestamisvõimest.
Nernsti võrrand
[muuda]Selleks, et hinnata mis suunas toimub reaktsiooni antud tingimustel, on vajalik teada Gibbsi vabaenergia märki ja (+-) ja väärtus. Seda on võimalik leida läbi võrrandi:
ΔrG = ΔrG° + RT·lnQ,
kus Q on reaktsiooni quotient:
aOxA + bRedB → a’RedA + b’OxB
Q = [RedA]a[OxB]b/[OxA]a[RedB]b
Tasakaalu olekus Q = K. Suuruseid nurksuludes on interpreteeritud kui molaarsed kontsentratsioonid. Gaasi faasis reaktsioonidele on molaarsed kontsentratsioonid asendatud osarõhkudega. Võttes arvesse, et
Ecell = −ΔrG/nF ja Erakk° = −ΔrG°/nF
tuletatakse Nernsti võrrandi:
Erakk = Erakk° − RT/nF·ln(Q)
Reaktsioon on spontaanne, kui antud tingimuste all Erakk > 0, mis vastab ΔrG < 0.
Tasakaaluolekus Erakk = 0 ja Q = K, saadakse temperatuursõltuvust
ln(K) = nF/RT·Erakk°
pH mõju
[muuda]Paljude reaktsioonide jaoks vee lahuses elektroonne potentsiaal muutub pH muutusega, sest redoks paari redutseeritud osakesed tavaliselt on palju tugevamad Brønstedi alused, kui oksüdeeritud osakesed. Kui redoks paaril toimub ne electronide ja nH protoonide üleminek
Ox + nee- + nHH+ → RedHnH Q=[RedHnH]/([Ox][H+]H+) ja
Kui kasutada ln[H+] = ln 10 log[H+], pH = -log[H+] ja defineerida kui
,
elektroodi potentsiaali võib väljendada
E=E’- (nHRT*ln10/neF)*pH
25°C juures
E=E’- ((0,059V)nH/neF)*pH
Potentsiaal kahaneb pH kasvuga.
Latimeri diagramm
[muuda]Latimeri diagrammil (reduktsiooni potentsiaalne diagramm) on elemendi erinevad oksüdatsiooni vormid kirjutatud ühel real, kõige rohkem oksüdeeritud vorm on kirjutatud vasakul ja osakesed paremale on antud kasvava oksüdatsiooni astme järjekorras. Naaber vormid on ühendatud noolega, mis näitab redutseeritud vormi suunas. Noole kohal on kirjutatud paari standardse potentsiaali arvuline väärtus voltides[1].
Näiteks, kloori Latimeri diagramm happelises keskkonnas on järgmine:

Kuna paljud pool-reaktsioonid sisaldavad H+ või OH- ioone ja potentsiaal varieerub pHga, siis Latimeri diagramme võib kasutada ainult fikseeritud pH väärtuste jaoks (tavaliselt diagramme antakse pH=0 ja pH=14 juures).
Selleks, et leida standardse potentsiaali paarile, mis koosneb mitte naaber-osakestest (mis on kahe teiste paaride kombinatsioon) tuleb summerida pool-reaktsioonide Gibbsi vaba energiaid, mitte potentsiaale.
ΔGa+b= ΔGa + ΔGb
-nFEa+b= -naFEa–nbFEb, E°a+b=(naE°a+nbE°b)/(na+nb)[1]
Näide. Et leida HClO2/Cl2 paari E° väärtus happelises keskkonnas, tuleb kasutada järgmisi pool-reaktsioone HClO2+2e-→HClO (E°=+1,7) ja HClO+e-→1/2Cl2 (E°=+1,6). Nende summa on antud paari pool-reaktsioon ja E°=2*1,7+1,6/(1+2)=1,7
Osakestel on tendents disproportsioneerumiseks kaheks naabriteks kui Latimeri diagrammil potentsiaal paremal on kõrgem kui vasakul[1].
Näide. Termodünaamiliselt ainel HClO2 on tendents disproportsioneeruda aineteks HClO ja ClO2
Frosti diagramm
[muuda]
Elemendi Frosti diagramm on graafik, mille ühel teljel on paari volt-ekvivalent () ja teisel – oksüdatsiooniaste (). Antud diagramm näitab kuidas erinevate oksüdatsiooni vormide formeerumisel Gibbsi energiad varieeruvad oksüdatsiooni astmega.[1]
Diagrammi ehitamine
[muuda]
Punkt (0,0) vastab elemendile 0-oksüdatsiooni astmes. Selleks, et ehitada teisi punkte, iga oksüdatsiooni astme jaoks tuleb võtta väärtus paarile kus redutseeritud vorm on 0-oksüdatsiooni astmes, ja korrutada oksüdeeritud vormi oksüdatsiooniastmega.[3]
Näide. Volt-ekvivalent väärtus, , Mn2+ jaoks on 2, Mn2O jaoks on 4.
Frosti diagrammi omadused:
[muuda]- 1. Kõige stabiilsem elemendi oksüdatsiooni aste vastab osakesele, mis asub kõige madalamal Frosti diagrammil.
Näide. Mn2+ on kõige stabiilsem mangaani oksüdatsiooni aste happelises keskkonnas.
- 2. Kahe punkti ühendava liini kallak (tg α) on võrdne paari standardse potentsiaaliga, mida järsem liin, seda kõrgem potentsiaal.
- 3. Oksüdeerija paarist rohkem positiivse kallakuga allub redutseerimisele.
- 4. Redutseerija paarist vähema positiivse kallakuga allub oksüdeerimisele.
Näide. H3MnO4 on ühendatud madalamate oksüdatsiooniastmete järsu kallaku joonega, mis näitab et see osake on hea oksüdeerija standardsetes tingimustes.
- 5. Kui osakese punkt asub diagrammil kahte naaberosakest ühendava joone kohal, siis see osake on ebastabiilne disproportsioneerumise vastu.
Näide. Kuna Mn3+ asub Mn2+ ja MnO2 ühendava joone peal, siis see disproportsioneerub nendeks kaheks osakeseks läbi reaktsiooni 2Mn3+(aq)+2H2O(l) → Mn2+(aq) + MnO(t) + 4H+(aq)
- 6. Kaks osakest alluvad komproportsioneerumisele vahepealseks osakeseks, mis asub neid kahte osakest ühendava joone all. Vahepealses osakeses antud juhul on madalam Gibbsi vabaenergia, kui naabrite keskmine energia ja komproportsioneerumine on termodünaamiliselt soodne.[1]
Pourbaix' diagramm
[muuda]
Pourbaix' diagramm (E-pH diagramm) on kaart potentsiaali ja pH tingimustest, mille juures osakesed on stabiilsed vees.
Horisontaalsed jooned eraldavad osakesi, mis on seotud ainult läbi elektronide ülekande (redoks reaktsioon), vertikaalne eraldab osakesi, mis on seotud läbi prootonite ülekande, ja kaldjooned eraldavad osakesi, mis on seotud nii elektronide, kui ka prootonite ülekande läbi.
Raua lihtsustatud Pourbaixi diagramm sisaldab järgmisi reaktsioone:
1) Fe3+(aq) + e- → Fe2+(aq) E°= 0.77V
Reaktsioon ei sisalda H+ ioone ja selle potentsiaal on pHst sõltumatu, järelikult talle vastab horisontaalne joon, mis eraldab Fe3+ ja Fe2+ domineerimise piirkondi.. Kui keskkond sisaldab antud joonest kõrgema potentsiaaliga paari, siis oksüdeeritud osakesed Fe3+, on peamine raua vorm.
2) Fe3+(aq) + 3H2O(l) → Fe(OH)3(t) + 3H+ (aq)
See reaktsioon ei ole redoks reaktsioon ja ta ei ole tundlik elektrilise potentsiaali vastu oma keskkonnas. Ta on esindatud vertikaalse joonega diagrammil. Aga see piir sõltub pHst: madala pH juures domineerib Fe3+(aq), kõrgema pH juures peamised osakesed on Fe(OH)3(t).
3) Fe(OH)3(t) + 3H+(aq) + e-→ Fe2+(aq) + 3H2O(l)
Selle reaktsiooni jaoks on potentsiaali/pH kaldenurk võrdne nH/ne=-3[1].
Vee stabiilsuse ala
[muuda]Helesinised kaldjooned Pourbaixi diagrammil vastavad ülemisele ja alumisele vee termodünaamilise stabiilsuse ala piirdele. Need liinid on vastavalt O2/H2O ja H+/H2 paaride potentsiaalid.
Vesi võib käituda nagu oksüdeerijana, kui ise redutseerub vesinikuks, H2:
H2O(l) + e- →1/2H2(g) + OH- (aq)
Hüdroonium ioone redutseerimise jaoks vees
H+(aq) + e- →1/2H2(g)
iga pH juures ( ja H2 osarõhu 1 bar) Nernsti võrrand annab E=-0,059V pH
Vesi võib olla redutseerijana, kui ise oksüdeerub hapnikuks, O2:
2H2O(l) → O2(g) + 4 H+ (aq) + 4e-
Kui hapniku osarõhk on 1 bar, siis Nernsti võrrand annab
E= 1.23V - 0.059V pH
Redutseerija, mis võib ruttu redutseerida vett vesinikuks, või oksüdeerija võimeline ruttu oksüdeerima vett hapnikuks ei saa eksisteerida veelahuses[1].
References
[muuda]- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 Atkins, P.W.; Overton, T.L.; Rourke, J.P.; Weller, M.T. (2010). Shriver and Atkins' Inorganic Chemistry. New York: Oxford University Press.
- ↑ McCafferty, E. (2007). Standard electrode potentials of the elements as a fundamental periodic property of atomic number. Electrochimica Acta, 52(19), 5884–5890.
- ↑ Третьяков, Ю.Д. (2004). Неорганическая химия. Москва: Академия, Т.1.









































![{\displaystyle E=E^{\circ }-{\frac {RT}{n_{e}F}}\ln \left({\frac {[RedH_{n_{H}}]}{[Ox][H^{+}]^{n_{H}}}}\right)=E^{\circ }-{\frac {RT}{n_{e}F}}\ln \left({\frac {[RedH_{n_{H}}]}{[Ox]}}\right)+{\frac {n_{H}RT}{n_{e}F}}\ln([H^{+}])}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dc4c8ddf71b51481bfa4a011e9bb3c1e0f533b48)

![{\displaystyle E^{\prime }=E^{\circ }-{\frac {RT}{n_{e}F}}\ln \left({\frac {[RedH_{n_{H}}]}{[Ox]}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ebe350838ff1733e5064ebe5b8e999355491367d)





