Anorgaaniline Keemia/Lihtained
Lihtained on ained, mis koosnevad ainult ühe elemendi aatomitest. Olenevalt sideme tüübist, esineb metalle (Na, Mg jt) ning mittemetalle (H2, N2 jne). Lisaks saab eristada molekulaarseid ja atomaarseid gaase. Üks lihtaine võib omada mitu struktuuri ehk paigutada aatomeid erinevalt, mis tihti sõltub välisfaktoritest nagu temperatuur ja rõhk. Antud artiklis me vaatleme erinevate lihtainete struktuure.
13. rühm
[muuda]Boor
[muuda]
13. rühmas on kõikidel ainetel erinev struktuur. Boor annab mitu erinevat huvitavat struktuuri. Üheks neist on α-romboeedriline boor, kus on 12-st aatomist koosnev ikosaeedriline rakk, milles iga aatom on seotud viie lähima aatomiga. Kolme valentselektroni tõttu ei saa boor anda viit sidet, mistõttu arvatakse, et tegu on kolmetsentrilise elektrondefitsiitse sidemega, kus elektronide laeng on koondatud kolme kõrvuti oleva aatomi vahelise kolmnurga keskele[1].
Sünteetiliselt on võimalik saada ka α-tetragonaalset boori, aga ainult õhukese kihina ja ainult boorkarbiidi (B50C2) ja boornitriidi (B50N2) alustel.[2]
β-rombeedrilise struktuuri rakk koosneb 105-108 aatomist. Peamiselt moodustuvad 12-st aatomist koosnevad ikosaeedrid, mõned üksikud ikosaeedrid põimuvad oma vahel. Rakus on ka 10 boori aatomist koosnev hulktahukas ja üks tsentraalne boori aatom.[2] β-rombeedriline struktuur on termodünaamilislt kõige püsivam boori allotroop.[3]

γ-boor koosneb B12 ja B2 ühikutest, mis on paigutatud sarnaselt NaCl struktuurile. Tegu on tehisliku struktuuriga, mida saab teisi allotroope kokku surudes 12–20 GPa ja kuumutades 1500–1800 °C juures. Tavatingimustel on allotroop püsiv.[4]
Boor ühendites esineb peamiselt boriididena, mida jagatakse booririkasteks ja metallirikasteks. Kui boori:metalli suhe on rohkem kui 4:1 loetakse boriidi booririkkaks, kui vähem on tegu metallirikka boriidiga. Ekstreemseteks näideteks on YB66 ja Nd2Fe14B. Booririkkaid ühendeid annavad peamiselt siirdemetallid, lantanoidid ja aktinoidid.
Alumiinium
[muuda]Alumiiniumi puhul on tegemist metalliga ja struktuurilt on tegu tahk-tsentreeritud kuubiga, mis on üks tihedaimaid struktuure, kus 74% ruumist on täietud.
14. rühm
[muuda]Süsinik
[muuda]
14. rühma esimeseks elemendiks on süsinik. Süsinikul on kaks peamist allotroopi, milleks on grafiit ja teemant. Grafiidis on süsiniku aatomid sp2 hübridisatsioonis, mistõttu on neil kolm σ-sidet ja üks π-side, mis on delokaliseeritud. Aatomitest moodustunud kuusnurksetest tsüklitest tekib tasapinnaline kiht, mida nimetatakse grafeeniks. Grafiit koosneb mitmest grafeenikihist, mida hoiavad koos van der Waalsi jõud. Kihtide vahe on 0,335 nm ja olenevalt kihtide paigutusest on tegu kas α (heksagonaalne) või β (romboeedrlinine) struktuuriga.[5]
2D struktuuriga on süsiniknanotorud ja fullereenid. Nagu grafiidis on ka neis süsinik sp2 hübridisatsioonis, kuid fullereenides pole kõik tsüklid kuuelülilised, vaid on ka viiest aatomist koosnevaid tsükleid. Fullereenid on saanud nime sellest, et meenutavalt kujult jalgpalli, kuna tegu on kerakujulise struktuuriga[6]. Nanotorud on torukujulised grafeenikihid, mis võivad olla ühe- või mitmekordsete seintega.[7]

Süsiniku teiseks peamiseks struktuuriks on teemant, mis on ka terve 14. rühma elementide peamine struktuur. Teemantis on süsiniku aatomid sp3 hübridisatsioonis, moodustades tetraeedrilise struktuuri. Iga aatom moodustab sideme nelja lähima naabriga.[8] Teemant on väga kõva materjal, kuid normaaltingimustel püsivam on siiski grafiit. Teemant on metastabiilne, aga selle ülemineku kiirus grafiidiks on mittearvestatav. Üleminek muutub kiireks alles temperatuuridel üle 4500 K.[9]
Süsiniku ioone nimetatakse karbiidideks ja need jagunevad omakorda alamrühmadesse. Soolataolisi ehk ioonilisi karbiide moodustavad esimese, teise ja kolmanda rühma metallid, lisaks lantaan ja alumiinium. Kõige tavalisem rühm on metaniidid, kus karbiidiks on üks neljalaenguline süsiniku aatom C4−, Al4C3, Mg2C. Lisaks on ka atsetüliid ja allüleniid, kus ioonideks on vastavalt kolmiksidemega seotud kaks süsiniku C22−, Na2C2, LaC2, või kaksiksidemetega seotud kolm aatomit C34− Li4C3, Mg2C3.[10] Boori ja räniga moodustab süsinik kovalentsed karbiidid. Ränikarbiidi SiC struktuur on sarnane teemantile ja boorkarbiit B4C omab erilist struktuuri, kus ikosaeedrilised boori klastrid on omavahel ühendatud süsinike aatomitega.[11]
Räni
[muuda]Räni peamiseks struktuuriks on teemanti struktuur kus aatomid on sp3 hübridisatsioonis ja seotud nelja lähima aatomiga.[12] Sellise struktuuriga räni jagatakse monokristalliliseks ja polükristalliliseks. Monokristallilises struktuuris puuduvad üleminekud ühest kristallist teise ja kristallstruktuur on ühtne üle terve aine.[13] Polükristalliline koosneb paljudest väikestest kristallidest, mille suunad ei pea olema samad.[14] Lisaks on ränil amorfne vorm, millel puudub kaugele ulatuv korrapära. Amorfses ränis on aatomeid, millel pole täidetud okteti reegel ja seetõttu on struktuuris sideme moodustamis võimelisi aatomeid ja see omakorda võib põhjustada anomaalseid elektrilisi omadusi.[15]
Silitsiidid on ühendid ränist ja elektropositiivsemast aatomist. Omadustelt on need sarnasemad boriididele kui karbiididele. Silitsiide annavad kõik leelis- ja leelismuldmetallid peale berülleumi ja suur osa siirdemetalle. Silitsiidid saavad olla metallitaolised ja juhtida elektrit, sellisteks ühenditeks on Cu5Si, Fe3Si, Mn3Si. Räni võib olla paaris U3Si2 või moodustada tetraeedrilisi struktuure KSi, lisaks võib räni moodustada ahelaid CaSi, SrSi või 2D-struktuure, mille vahel on metalli aatomid β-USi2.
Plii
[muuda]
14. rühma peamine struktuur on teemant, mida moodustavad kõik elemendid peal plii. Plii väliskihi s- ja p-orbitalide energiad ei kattu omavahel nagu teistel 14.rühma elementidel. Teemanti struktuuriga energiate vahe suureneks, seetõttu on pliile kasulikum moodustada tahk-tsentreeritudkuubilist struktuuri, kuna s-orbitali elektronid ei käitu väliskihi elektronidena ja sideme moodustavad seepärast ainult p-elektronid. See on omane metallilistele elementidele. [16]
15. rühm
[muuda]Lämmastik
[muuda]Rühma esime element lämmastik on normaaltingimustel dimeerina N2. Lämmastik anioonsel kujul on peamiselt nitriidina, kus lämmastikul on laeng 3−. Esimesest rühmast moodustab nitriidi ainult liitium Li3N, teisest rühmast moodustavad enamus metalle nitriidid Be3N2, Mg3N2, Ca3N2.[17] p-bloki mittemetallilistest elementidest on teada boornitriidi, räninitriidi ja fosfornitriid. Aluminium, gallium ja indium tekitavad teemantisarnase struktuuri, kus iga aatomit ümbritseb neli teise elemendi aatomit. Siirdemetallidest 3–6 rühm annavad püsivaid nitriide, 7 ja 8 rühma nitriidid on kergesti lagunevad, 11 ja 12 rühma nitriidid on väga ebapüsivad ja võivad laguneda plahvatuslikult.[18][19] Nitriididele lisaks on lämmastik võimeline andma pernitriide N22− ja asiide N3−.[20]
Fosfor
[muuda]
Fosfori kaks peamist allotroopi on valge ja punane fosfor. Valge fosfori struktuur koosneb neljast aatomist, mis moodustavad kolmnurkse püramiidi. Toatemperatuuril on püsiv α vorm, 195,2 K juures on püsivamaks vormiks β. Vormide erinevus sõltub P4 struktuuri ühikute orientatsioonist.[21] Üldiselt on valge fosfor väga ebapüsiv ja muutub ajapikku punaseks fosforiks. Valge fosfori üleminekut kiirendab valgus ja kuumutamine. Punane fosfor koosneb sarnastest püramiididest, kuid need on omavahel ühendatud ja tekib polümeerne struktuur.[22]

Kõige püsivamaks struktuuriks on must fosfor. Struktuurilt meenutab must fosfor grafiiti, kuid see pole tasapinnaline. Sellist struktuuri saadakse valge fosfori kuumutamisel kõrgel rõhul. Ka omaduste poolest on must fosfor väga sarnane grafiidile.[23][24]
Fosfiidideks nimetatakse ühendeid kus fosfor on seotud endast elektropolaarsema elemendiga. Lihtsaimaks fosfiidiooniks on P3−, sellisteks ühenditeks on AlP, Zn3P2. Lisaks on fosfor võimeline andma polüfosfiide, millest lihtsaim on P24−, kuid ahel võib olla veelgi pikem Pn−, ning isegi klastrina P113-. Seetõttu on paljudel elementidel palju erinevaid fosfiide, näiteks kaaliumil üheksa ja niklil kaheksa Ni3P, Ni5P2, Ni12P5, Ni2P, Ni5P4, NiP, NiP2, NiP3.[25][26]
Arseen, antimon ja vismut
[muuda]15. rühmas moodustavad enamus elemente grafiidile sarnase struktuuri. Fosfori puhul oli tegemist musta fosforiga, aga see erineb teistest struktuuridest. Kui fosfori puhul oleks kihis nagu kaks platood kus aatomid asuvad, siis teiste elementide puhul on struktuuris astmeliselt seotud tugitooli konformatsioonis tsüklid.[27]
16. rühm
[muuda]Hapnik
[muuda]Hapniku struktuur tavatingimustel on dimeer O2. Oksiidid on ühendid, mis sisaldavad hapniku oksüdatsiooni astmega −II (O2−). Oksiidid on ühed enam levinud ühendid maal. Metallide oksiidid võtavad enamasti polümeerse struktuuri, kus üks oksiidioon on enamasti seotud kolme või kuue metalli aatomiga.[28] Molekulaarsete oksiidide näideteks on süsinikmonooksiid ja süsinikdioksiid, lisaks kõik lämmastiku oksiidid. Teine tuntud hapniku ühendite grupp on peroksiidid O22−. Leelis- ja leelismuldmetallid moodustavad peroksiide hästi, kuid siirde metallid mitte. Enim uuritud on ZnO2, HgO2 ja CdO2. Lisaks on olemas hüperoksiidid O2−, mis moodustuvad peamiselt leelis- ja leelismuldmetallidega. CsO2, RbO2, KO2.
Väävel
[muuda]
Väävel annab üle 30 erineva allotroobi ja neist levinuim struktuur on ringikujuline, mis koosneb peamiselt 8 aatomist S8, kuid need võivad olla ka 7 aatomilised. S7 on värvi poolest sügavam kollane kui S8 ja seda on alati tasakaalus S8-ga. Kõige väiksem ring on 5-lüliline, mida on siiani leitud ainult aurudes, ja suurimad on 20-lülilised.[29]

16. rühma oluliseimas struktuuris on tegu pikade ahelatega. Selline struktuur on omane väävlile, seleenile ja telluurile. Ahelad on otsast vaadates kolmnurkse üles ehitusega ja nad on omavahel seotud van der Waalsi jõududega.
Sulfiidid on ühendid, mis sisaldavad väävli aniooni S2−. Enamus metalle moodustab sulfiide, mistõttu on paljud sulfiidid metalli maakideks, Ag2S, Hg2S, PbS.[30] Lisaks on olemas polüsulfiidid, mis struktuurilt meenutavad polümeeri ja millest lihtsaim on S22− ning üldvalem Sn2−.[31]
Poloonium
[muuda]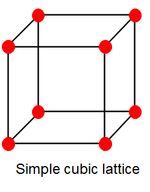 Polooniumil on kaks allotroopi, millest α on väga eriline. α on ainuke teadaolev lihtkuubiline struktuur, mis koosneb ainult ühest elemendist. β vormis on poloonium romboeerdilise struktuuriga.[32]
Polooniumil on kaks allotroopi, millest α on väga eriline. α on ainuke teadaolev lihtkuubiline struktuur, mis koosneb ainult ühest elemendist. β vormis on poloonium romboeerdilise struktuuriga.[32]
17. ja 18. rühm
[muuda]Kõik 17. rühma elemendid on tavatingimustes dimeerina X2. Halogeniidideks nimetatakse ühendeid, mis sisaldavad ühte või enam halogeeni aatomit, fluoriidid, kloriidid, bromiidid, jodiid. Halogeenid annavad halogeniide kõigi elementidega peale 18. rühma elementide. Joodil on omapärane võime moodustada I3− kompleksi, mis ei ole reaktiivne, kuid laboratoorsetes tingimustes on saadud KI3 ja TlI3.
18. rühmas on väärisgaasid, mis ei reageeri teiste elementidega, kuna neil on täidetud okteti reegel. Tavatingimustel on tegu atomaarsete gaasidega, kuid piisavalt suurel rõhul tekitavad nad kindlaid struktuure. Kõik elemendid peale heeliumi hoodustavad tahk-tsentreeritud kuubi, mis tavaliselt on omane metallidele. Heelium ainukesena moodustab heksagonaalse tihepakendi. Need kaks struktuuri on kõige tihedamalt täidetud, täites 74% ruumist.
Heksagonaalne tihepakend
Viited
[muuda]- ↑ Nelmes, R. J.; Loveday, J. S.; Allan, D. R.; Besson, J. M.; Hamel, G.; Grima, P.; Hull, S. (1993). "Neutron- and x-ray-diffraction measurements of the bulk modulus of boron". Physical Review B. 47 (13): 7668–7673. Bibcode:1993PhRvB..47.7668N. doi:10.1103/PhysRevB.47.7668.
- ↑ 2,0 2,1 Wiberg, N. (2001). Inorganic chemistry. San Diego: Academic Press. ISBN 0-12-352651-5.
- ↑ van Setten M.J.; Uijttewaal M.A.; de Wijs G.A.; de Groot R.A. (2007). "Thermodynamic stability of boron: The role of defects and zero point motion". J. Am. Chem. Soc. 129 (9): 2458–2465. doi:10.1021/ja0631246. PMID 17295480
- ↑ Oganov, A. R.; Chen, J.; Ma, Y.; Glass, C. W.; Yu, Z.; Kurakevych, O. O.; Solozhenko, V. L. (12 Feb 2009). "Ionic high-pressure form of elemental boron". Nature. 457 (7027): 863–868. arXiv:0911.3192. Bibcode:2009Natur.457..863O. doi:10.1038/nature07736. PMID 19182772
- ↑ Lipson, H.; Stokes, A. R. (1942). "A New Structure of Carbon". Nature. 149 (3777): 328. Bibcode:1942Natur.149Q.328L. doi:10.1038/149328a0
- ↑ Osawa, E. (1970). "Superaromaticity". Kagaku. 25: 854–863.
- ↑ Das, S. (2013). "A review on Carbon nano-tubes - A new era of nanotechnology". International Journal of Emerging Technology and Advanced Engineering. 3 (3): 774–781. ISSN 2250-2459
- ↑ Ashcroft, Neil W.; Mermin, N. David (1976). Solid state physics. Holt, Rinehart and Winston. p. 76. ISBN 978-0030839931.
- ↑ Rock, Peter A. (1983). Chemical Thermodynamics. University Science Books. p. 257–260. ISBN 9781891389320.
- ↑ Shriver, Duward F.; Atkins, P. W.; Cooper, H. Langford. (1990) Inorganic Chemistry. pp. 350-375.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. pp. 318–22. ISBN 0-08-022057-6.
- ↑ Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4 pp. 331–335
- ↑ Monkowski, J. R.; Bloem, J.; Giling, L. J.; Graef, M. W. M. (1979). "Comparison of dopant incorporation into polycrystalline and monocrystalline silicon". Appl. Phys. Lett. 35 (5): 410–412. doi:10.1063/1.91143.
- ↑ Kolic, Y (1995). "Electron powder ribbon polycrystalline silicon plates used for porous layer fabrication". Thin Solid Films. 255: 159. Bibcode:1995TSF...255..159K. doi:10.1016/0040-6090(94)05644-S
- ↑ R.W. Collins, et al., "Evolution of microstructure and phase in amorphous, protocrystalline, and microcrystalline silicon studied by real time spectroscopic ellipsometry", Solar Energy Materials and Solar Cells, 78(1-4), pp. 143-180, 2003.
- ↑ Smart, Lesley E.; Moore, Elaine A. (2005). Solid state chemistry. pp. 189-191.
- ↑ Gregory, Duncan H. (2001). "Nitride chemistry of the s-block elements". Coord. Chem. Rev. 215: 301–345. doi:10.1016/S0010-8545(01)00320-4
- ↑ Siller, L.; Peltekis, N.; Krishnamurthy, S.; Chao, Y.; Bull, S. J.; Hunt, M. R. C. (2005). "Gold film with gold nitride—A conductor but harder than gold" (PDF). Appl. Phys. Lett. 86 (22): 221912. Bibcode:2005ApPhL..86v1912S. doi:10.1063/1.1941471.
- ↑ Shanley, Edward S.; Ennis, John L. (1991). "The Chemistry and Free Energy Formation of Silver Nitride". Ind. Eng. Chem. Res. 30 (11): 2503. doi:10.1021/ie00059a023.
- ↑ S. Bräse; C. Gil; K. Knepper; V. Zimmermann (2005). "Organic Azides: An Exploding Diversity of a Unique Class of Compounds". Angewandte Chemie International Edition. 44 (33): 5188–5240. doi:10.1002/anie.200400657. PMID 16100733.
- ↑ Simon, Arndt; Borrmann, Horst; Horakh, Jörg (1997). "On the Polymorphism of White Phosphorus". Chemische Berichte. 130 (9): 1235. doi:10.1002/cber.19971300911.
- ↑ Welford C. Roberts; William R. Hartley. Drinking Water Health Advisory: Munitions (illustrated ed.). CRC Press, 1992. p. 399. ISBN 0873717546
- ↑ A. Brown; S. Runquist (1965). "Refinement of the crystal structure of black phosphorus". Acta Crystallogr. 19 (4): 684. doi:10.1107/S0365110X65004140.
- ↑ Robert Engel. Synthesis of Carbon-Phosphorus Bonds (2 ed.). CRC Press, 2003. p. 11. ISBN 0203998243.
- ↑ Jeitschko, W.; Möller, M. H. (1987). "Phosphides and Polyphosphides of the Transition Metals". Phosphorus and Sulfur and the Related Elements. 30: 413. doi:10.1080/03086648708080608.
- ↑ Blackman, C. S.; Carmalt, C. J.; O'Neill, S. A.; Parkin, I. P.; Molloy, K. C.; Apostolico, L. (2003). "Chemical vapour deposition of group Vb metal phosphide thin films". Journal of Materials Chemistry. 13 (8): 1930. doi:10.1039/b304084b.
- ↑ Biberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Inorganic Chemistry. Academic Press. ISBN 978-0-12-352651-9.
- ↑ Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ↑ Tebbe, Fred N.; Wasserman, E.; Peet, William G.; Vatvars, Arturs; Hayman, Alan C. (1982). "Composition of Elemental Sulfur in Solution: Equilibrium of S 6, S7, and S8 at Ambient Temperatures". Journal of the American Chemical Society. 104 (18): 4971–4972. doi:10.1021/ja00382a050
- ↑ Harbhajan Singh. Mycoremediation: Fungal Bioremediation. p. 509.
- ↑ Steudel, Ralf (2007). "Sulfur: Organic Polysulfanes". Encyclopedia of Inorganic Chemistry. Encyclopedia of Inorganic Chemistry. Weinheim: Wiley-VCH. doi:10.1002/0470862106.ia233.pub2. ISBN 0470860782.
- ↑ Miessler, Gary L.; Tarr, Donald A. (2004). Inorganic Chemistry (3rd ed.). Upper Saddle River, N.J.: Pearson Prentice Hall. p. 285. ISBN 0-13-120198-0.

