Anorgaaniline Keemia/Happed ja alused
Happed ja alused on levinud ühendite klassid, mida on defineeritud eri teooriates mitmeti. Happeks loetakse molekuli või iooni, mis käitub uuritavas keskkonnas elektrontiheduse aktseptorina – andes vesilahusesse vesinikiooni või olles elektronpaari aktseptor. Alusele seevastu on iseloomulik olla elektrontiheduse doonor – andes vesilahusesse hüdroksiidiooni, käitudes vesinikiooni aktseptorina või elektronpaari doonorina. Happed ja alused eksisteerivad kõikjal meie ümber: nii elusorganismides toidu lagundamiseks ja valkude sünteesiks [1], tööstuses väetiste, akude ja pesuvahendite tootmiseks kui ka toiduainetes.
Hapete ja aluste teoreetiline käsitlus
[muuda]Alus-happe, redoks- ja radikaalreaktsioonid on keemias kolm põhilist reaktsioonitüüpi. Alus-happe protsesse käsitletakse erinevates eluvaldkondades, hõlmates igapäevaelu puudutavaid, sotsiaalteaduslikke, hariduslikke ning ajaloolisi asjaolusid. Kuna alus-happe kontseptsioon kirjeldab igapäevaeluga seonduvaid ilminguid, siis on inimeste kõnekeelde tekkinud mõisted ja väljendid nagu hapu maitse, maohape, sipelghape jne. Samal põhjusel on alus-happe käsitlusel tekkinud ka sotsiaalteadustes märkimisväärne mõju: kasina teadusliku info jagamine on tavapärane televisiooni reklaamides, kus tutvustatakse kosmeetika ja puhastusvahendite “pH-ga” produkte, erinevaid dieete ja toiduaineid, mis redutseerivad sinu organismi happelisust, vähendamaks vähi riski jms. Vasturääkivusi on põhjustanud õppekava, mis igal uuel õppeastmel õpetab üks-ühele vastuolulisi ajaloolisi alus-happe mudeleid. [2]

Kirjeldamaks võimalikult paljude ühendite vahelisi reaktsioone on hapete ja aluste definitsioonid läinud aina üldisemaks. Praeguseks mõnevõrra iganenud, kuid siiski laialdast kasutust leidev Brønsted-Lowry teooria laiendas Arrheniuse teooriat, jättes piiritlemata alus-happe reaktsiooni toimumise keskkonna [3]. Lewise teoorial õnnestus jätkata definitsioonide üldistamist ning kaasata seeläbi ka koordinatiivühendid.
Kõigi mudelite puhul üldised aspektid:
- Dissotsatsiooni mudelist (Arrhenius): hape on aine, mis dissotseerumisel tõstab vesilahuses H+ ioonide kontsentratsiooni. Alus on selline aine, mis dissotseerumisel tõstab vesilahuses OH- ioonide kontsentratsiooni.[4]
- Solvendi mudelist (Franklin): ainet, mis põhjustab lahuses positiivsete ioonide kontsentratsiooni tõusu ning negatiivsete ioonide kontsentratsiooni vähenemist, nimetatakse happeks. Ainet, mis põhjustab lahuses positiivsete ioonide kontsentratsiooni vähenemist ning negatiivsete ioonide kontsentratsiooni tõusu, nimetatakse aluseks.[5]
- Prootoni mudelist (Brönsted & Lowry): ainet, millele on võimalik siduda prootonit, nimetatakse aluseks ning ainet, mis on võimeline loovutama prootonit, nimetatakse aluseks. Happe ja aluse vahelist keemilise reaktsiooni võrrandit saame väljendada:
HA + B = A- + BH+ ,
Kus HA tähistab hapet, B tähistab alust, BH+ tähistab B konjugeeritud hapet ning A- tähistab HA konjugeeritud alust.[6]
- Elektronpaari mudel (Lewis): ainet, mis käitub elektronpaari aktseptorina, nimetatakse happeks, aluseks nimetatakse ainet, mis käitub elektronpaari doonorina. Alus-happe reaktsiooni käigus toimub elektronpaari üleminek.[6]
- Kõrgrõhu mudel (Lux & Flood): happena käituvad ained, mis on võimelised siduma oksiidiooni ning alusena käituvad ained, mis saavad loovutada oksiidiooni. See teooria on kasulik väärisgaasi ühendite, eriti ksenoonoksiidide, aga ka fluoriidide ja oksofluoriidide reaktsioonide süstematiseerimisel.[7]
- Fukui ja frontaalmolekulaarorbitali mudel: (elektrontiheduse jaotuse roll) Sõltuvalt elektrontiheduse jaotumisest käsitletakse hapetena neid aineid või aine osi, kuhu tõenäoliselt saab lisada elektroni. Alustena käsitletakse neid aineid, mis tõenäoliselt saavad elektroni loovutada.[8]

Lewise teooria lähtub eelkõige ühendite elektronstruktuuridest. Selle kohaselt on hape elektronpaari aktseptor (H+) ja alus elektronpaari doonor (NH3). Niiviisi jaotades on hapeteks ja alusteks võimalik jaotada väga suurt hulka orgaanilise ja anorgaanilisi ühendeid, mistõttu on see teooria laialdaselt kasutusel ka tänapäeval. Allpool toodud tabelis on kokkuvõtvalt toodud ühendite klassid, mida on võimalik Lewise teooria abil alusteks ja hapeteks jagada:[9]
| Lewise happed | Lewise alused |
|---|---|
| Prooton ja metalliioonid (H+, Cu2+, Fe3+) | Mittemetallide anioonid (Cl−, Br−, H−) |
| Molekulid, mille aatomil on vaba valentskihi orbitaal (BF3, AlCl3) | Ühendid ja ioonid, mille aatomil on vaba elektronpaar (NH3, CN−) |
| Elektrondefitsiitsed kaksiksidemetega ühendid (allüülsed katioonid, NO2) | Kaksiksidemetega ühendid, kus ei esine elektronide puudujääki (eteen, butadieen) |
| Ooniumioonid [NH4]+, [(CH3)O]+ | Kompleksanioonid [BF4]−, [SbF6]−, [PF6]− |
Erinevalt eelkäijatest kirjeldab teooria edukalt koordinatiivühendite moodustamist ning hõlmab ka Brønsted-Lowry aluseid ja happeid.[6]
Lewise teooriat võib veelgi üldistada, lähtudes elektronpaari asemel molekuli või iooni elektrontihedusest. Nii vaadeldes võib happeid käsitleda kui elektrontiheduse vastuvõtjaid ning aluseid kui elektrontiheduse doonoreid. Happe ja aluse vahelisel reaktsioonil toimub seega elektrontiheduste ühtlustumine ning seega happe elektrontiheduse kasv aluse arvelt. Lahustades solvendis happena käsitletavat ühendit, see esmalt dissotsieerub ning seejärel reageerib solvendi kui alusega langetades solvendimolekuli elektrontihedust. Reaktsiooni tulemusel kasvab solvooniumiooni (vees H3O+) kontsentratsioon. Aluselise aine lahustumise korral reageerib dissotsieerunud ühend solvendi kui happega, kasvatades solvaadi (vees OH−) kontsentratsiooni.
Fukui ja frontaalmolekulaarorbitali mudel
[muuda]Püüdes käsitleda happeid ja aluseid võimalikult üldisena, saame vaadelda neid elektrontiheduse muutuste kaudu. Selle käsitluse põhjal on happed ained, mis saavad elektrontihedust vastu võtta ning alused ained, mis saavad elektrontihedust loovutada. Elektrontihedus kirjeldab elektroni ruumipunktis asumise tõenäosust.
Fukui funktsioonid kirjeldavad, kui tõenäoliselt aine mingi osa saab liita või loovutada elektrontihedust.[10]

- Fukui funktsioon elektroni lisamiseks ainele:
f+(r) = ρN+1(r) – ρN(r)
- Fukui funktsioon elektroni eemaldamiseks ainelt:
f–(r) = ρN(r) – ρN–1(r)
Selle käsitluse järgi on H+ ideaalne hape – see tähendab, et vesinikioonil puudub elektrontihedus, mida loovutada, ta saab vaid elektrontihedust vastu võtta. Seetõttu on f– funktsioon defineerimatu, puudub tõenäosus, et H+ saab elektrontihedust loovutada.
Peamised hapete tüübid Fukui funktsioonide järgi
[muuda]Visualiseerides Fukui funktsioone saab hinnata aine võimet liita või loovutada elektrontihedust. Joonistel kujutatakse sinise värviga piirkondi, mis tõenäoliselt saavad elektrontihedust liita, seega käituvad hapetena. Punase värviga kujutatakse võimet elektrontihedust loovutada, seega on molekuli punane piirkond alus. Vaatleme järgnevalt nelja eri tüüpi hapet:[11]
1. tüüpi hape – H+ (s-LUAO):
H+ + OH– ⇋ H2O

Joonisel on näha, et selles reaktsioonis käitub happena H+ ioon, kuna temale saab liita elektrontihedust ning alusena OH– ioon, mille puhul näeme suurt punast osa, mis viitab võimele elektrontihedust loovutada.
2. tüüpi hape – metalli katioon (s-tüübi LUAO):
Na+ + F– ⇋ NaF

Jooniselt on näha, et Na+ käitub selles reaktsioonis happena, kuna sellel on terve osakese piires võimalik liita elektrontihedust ning alusena käitub F– ioon, kuna temal on võimalik elektrontihedust loovutada. Näeme, et selle käsitluse järgi käitub neoon happena.
3. tüüpi hape – tühi orbitaal (mittesiduv või lõdvendav π-tüübi LUMO)
BH3 + NH3 ⇋ H3B—NH3

Jooniselt on näha, et nii BH3 kui ka NH3 molekulid omavad korraga happelisi ja aluselisi piirkondi, aga NH3 molekulis on happelised piirkonnad aluselistest piirkondadest ära varjestatud. Seega antud juhul käitub alusena NH3 molekul, moodustades BH3-ga kompleksi. BH3 molekuli happelisus on tingitud п-tüübi LUMOst.
4. tüüpi hape – sigma side (lõdvendav σ-tüübi LUMO)
I2 + I– ⇋ I3–

Jooniselt on näha, et I2 molekulil on olemas nii happelised kui aluselised piirkonnad. Seega saab I2 molekul käituda nii happe (elektrontiheduse vastuvõtja) kui alusena (elektrontiheduse loovutajana). Reaktsioonis I– (alusega), käitub I2 happena.
SO3 + OH– ⇋ HSO4–

Jooniselt on näha, et nii SO3 kui ka OH– omavad happelisi ja aluselisi piirkondi ehk nad saavad elektrontihedust nii vastu võtta kui loovutada. Antud reaktsiooni puhul käitub SO3 happena ning OH– alusena.

SbF5 + F– ⇋ SbF6–

Jooniselt on näha, et SbF5 molekulil on olemas nii happelised kui aluselised piirkonnad. Seega saab SbF5 molekul käituda nii happe kui alusena. SbF5 puhul sõltub reaktsiooni toimumine ka katiooni suurusest. Kuna antimon on piisavalt suur aatom, siis ei ole viis fluori aatomit teda veel täiesti varjestanud ning tal on võime endale liita veel üks fluori aatom. Kui võrrelda omavahel SbF4+ iooni ja NF4+ iooni, siis on näha, et palju väiksema lämmastiku varjestavad neli fluori aatomit ning seetõttu ei saa talle rohkem fluori aatomeid liituda.
Hapete ja aluste reaktsioonide liigitamine
[muuda]Aluste ja hapete vahel toimuvad mitmeid reaktsioone, mida on võimalik jaotada põhimõtte järgi kolme rühma:[6]
- Kompleksi moodustumine happe ja aluse vahelisel reaktsioonil
- Vahetusreaktsioon, kus hape või alus asendab kompleksi koostisesse kuuluva happe või aluse
- Metateesi reaktsioon - vahetusreaktsioon, mille käigus tekib ka asendatud happest/alusest kompleks
Hapete ja aluste tugevus
[muuda]Enamasti mõistetakse happe tugevuse all selle võimet reaktsiooni käigus loovutada prooton kas solvendile või konkreetsele ühendile. Tugev hape dissotsieerub lahuses täielikult, samal ajal kui nõrga happe korral moodustub tasakaal dissotsieerunud ja dissotsieerumata vormi vahel. Hapete tugevuse iseloomustamiseks kasutatakse üldiselt happe dissotsiatsioonikonstanti , mis tasakaalu korral avaldub kui:
- ,
kus on happe dissotsieerunud vormi, vesinikiooni ja happe dissotsieerimata vormi tasakaalulised kontsentratsioonid. Tugevateks alusteks loetakse ühendeid, mis võivad olla prootoni aktseptoriks ka väga nõrkade hapete korral. Tavaliselt kasutatakse ka nende tugevuse iseloomustamiseks happe dissotsiatsioonikonstanti , mille väga väike väärtus viitab, et ülaltoodud tasakaal on väga tugevalt nihutatud prootoni sidumise suunas.[3]
Solvendi nivelleeriv toime
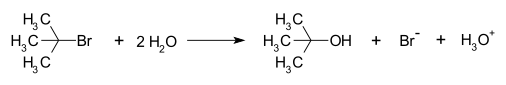
[muuda]Hape, mis on nõrk vees võib näida tugevana solvendis, mis on efektiivsem prootoni aktseptor. Seetõttu piisavalt aluseliste solventide korral ei pruugi olla võimalik eristada hapete tugevusi, sest kogu hape on deprotoneerunud vormis. Seda nähtust nimetatakse solvendi nivelleerivaks mõjuks. Igas lahuses on tugevaimaks happeks katioon ja aluseks anioon, mis tekivad solvendi autoionisatsioonil. Vesilahustes iga hape, mis on tugevam kui H3O+ annab vesikeskkonnas prootoni H2O-le ning tekib H3O+. Samuti alus, mis on tugevam kui OH− reageerivad vee molekuliga võttes sellelt prootoni ning seetõttu on tugevaimaks aluseks OH− ioonid. Eeltoodud põhjustel pole võimalik vesikeskkonnas määrata, kas HI on tugevam hape kui HBr, sest kogu hape on dissotsieerunud.[6]
Hapete tugevuse hindamine Born–Haberi tsüklist
[muuda]Hapete tugevust iseloomustav dissotsiatsioonikonstant on teoreetiliselt arvutatav Born–Haberi tsüklist, mis võtab arvesse happe ja vesiniku vahelise sideme dissotsiatsiooni, vesiniku ionisatsiooni, tekkinud happe radikaali elektronafiinsust, ioonide hüdratatsiooni ning entroopia efekte. Järgneval joonisel on toodud Born–Haberi tsükkel HCl jaoks.
Tulenevalt mitmesugustest parameetritest, mis on vajalik sellise tsükli koostamiseks on kiireks võrdlemiseks selline meetod tülikas, sest nõuab laia andmebaasi eri energiatest, mida ei pruugi ollagi võimalik eksperimentaalselt määrata.[12] Esimeses lähenduses piisab hapete tugevuste võrdlemiseks ainult nende sideme dissotsiatsioonienergiate ning happe radikaalide elektronafiinsuste võrdlemisest. See on võimalik tulenevalt asjaolust, et kuna happe dissotsiatsioon leiab aset vesilahustes on entroopiaefektid tühised, vesiniku ionisatsioonienergia on kõigi hapete jaoks sama ning dissotsieerumata happe dehüdratatsioonienergia on samas suurusjärgus ioonide hüdratatsioonienergiaga.[13]
Hapete-aluste tugevuse hindamine poolempiiriliselt
[muuda]Tulenevalt vajadusest hinnata hapete ja aluste tugevusi ilma ligipääsuta erinevatele andmebaasidele on välja pakutud mitmesuguseid erinevaid reegleid:[9]
- Paulingu reeglid võimaldavad hinnata oksohapete ja oksoanioonide tugevust, seostades omavahel hapete tugevuse oksrühmade arvu suurenemisega, mis võimaldab laialdasemat delokalisatsiooni. Selle kohaselt :
- Oksohappe happelisuskonstandi negatiivne kümnendlogaritm () avaldub kui:
- Astmeliselt dissotsieeruva mitmeprootonilise happe iga järgneva dissotsiatsiooniastme väärtus kasvab 5 ühiku võrra
- Oksoanioonide aluselisust saab hinnata valemist
- Metalliioonid käituvad vesilahustes happena, interakteerudes vee molekulidega ning moodustades nendega komplekse. Hüdrateeritud metalliiooni happelisust saab hinnata valemiga: , kus on metalliiooni elektronegatiivsus, – hüdrateeritud kompleksi raadius ning – metalliiooni laeng.
- Oksohapete tugevuste hindamiseks on Meek[14] välja pakkunud meetodi, mis tugineb Sandersoni printsiibile, mille kohaselt sama molekuli aatomite elektronegatiivsused ühtlustuvad. Sellise ühtlustumise tulemusena omandavad aatomid, mille elektronegatiivsus langeb negatiivse laengu ning aatomid, mille elektronegatiivsus kasvab, positiivse laengu. Kirjeldatud meetodit kasutades leitakse koefitsient :
,
kus korreleerub väärtusega ning võtab arvesse nii ühendi happelisust kui ka konjugeeritud aluse tugevust.
Kõvade ja pehmete happe-alus kontseptsioon (HSAB)
[muuda]HSAB on lähenemine, mida kasutatakse ühendite stabiilsuse ning reaktsioonimehhanismide kvalitatiivseks kirjeldamiseks. Selle kohaselt jaotatakse happed ja alused kõvadeks ning pehmeteks haliidioonidega moodustatud komplekside tugevuse alusel.[6]

Kõvad happed moodustavad komplekse kõvaduse kasvamise järjekorras: I− < Br− < Cl− < F−. Kuna F− on sellest reast väikseim ioon, siis on ta ka kõige kõvem alus ning moodustades kompleksi kõva happega, tekib kõrgema tasakaalukonstandiga kompleks. Pehmed happed moodustavad komplekse kõvaduse järjekorras: I− > Br− > Cl− > F−, kuna I− on halogeenidest suurim, siis on tegemist pehme alusega ning pehme alusega reageerivad hästi pehmed happed. Seega tekib pehme aluse ja pehme happe reaktsioonil püsiv kompleks. [6] Jooniselt (Joonis 1.) saab näha, et langeva trendiga katioonid on tugevad happed ning tõusva trendiga pehmed. Näiteks on Al3+ puhul tegemist tugeva happega, kuna tema tasakaalukonstant F− iooniga on kõrgem kui Cl− ja Br− ioonidega. Hg3+ on aga pehme hape, kuna tema tasakaalukonstant F− iooni puhul on madalam kui Cl−, Br− ja I− ioonide puhul. Kõrgem tasakaalukonstant viitab püsivama ühendi tekkele. See sobib ka varasemalt vaadeldud teooriaga, et kõvad alused ja happed on suure laengutihedusega väikesed osakesed ning pehmed happed ja alused on väikese laengutihedusega suured osakesed.
HSAB teooria järgi tähendab pehmus võimet moodustada kovalentset sidet, mida reguleerib orbitaalne interaktsioon. Kõvadus on võime moodustada ioonilist sidet ning seda reguleerivad elektrostaatilised interaktsioonid.


- Kõvasid happeid iseloomustavad väikesed mõõtmed, tugev solvatatsioon, suur positiivne laengutihedus ja madal elektronafiinsus. Kõvad happed on näiteks: Li+, H3O+ ja SO3.
- Pehmetele hapetele (Ag+, BH3, Pd2+) on iseloomulik suurem raadius, väike positiivne laengutihedus ning kerge polariseeritavus.
- Kõvadele alustele (NH3, H2O, OH−) on samuti iseloomulik väikse raadius, solvendi tugev solvatatsioon ning lisaks väga elektronegatiivsete tsentrite olemasolu.
- Pehmetel alustel (H−, I−, CO) on suur raadius, keskmiste elektronegatiivsustega tsentrid ning kerge polariseeritavus [9].
| Kõvad happed | Piiripealsed happed | Pehmed happed |
|---|---|---|
| , , , , , , , , , , , , , , , , , , , , , | , , , , , , , , | , , , , , , , , |
| Kõvad alused | Piiripealsed alused | Pehmed alused |
| , , , , , , , , , , , , , | , , , , , , Püridiin | , , , , , , , , , , , , |
Kontseptsiooni põhiliseks reegliks on, et kõvad ioonid moodustavad eelistatult kompleksi kõvade ioonidega ning pehmed ioonid kompleksi pehmete ioonidega. Näiteks saab HSAB teooria abil hinnata, kas naatriumjodiidi ja hõbe(I)nitraadi vahelisel reaktsioonil moodustub eelistatult hõbe(I)jodiid ja naatriumnitraat või jäävad ühendid lähteainete kujule.
Näiteid:
Li+ + F− → LiF↓
Kuna Li+ on kõva hape ning F- on kõva alus, siis moodustavad nad vees lahustumatu LiF. Liitiumhalogeniidi lahustuvus vees paraneb kui liikuda rühmas allapoole, F− < Cl− < Br− < I−, kuna I- on pehme alus, siis moodustuv ühend ei ole nii püsiv.
Ag+ + I− → AgI↓
Hõbedaioon moodustab jodiidiga vees lahustumatu ühendi AgI, kuna Ag+ on pehme hape ning I- pehme alus. Hõbehalogeniidi lahustuvus vees paraneb kui liikuda rühmas ülespoole, F− > Cl− > Br− > I−.
Hg2+ + 4SCN− → Hg(SCN)42–
Zn2+ + 4SCN− → Zn(NCS)42–
Kuna Hg2+ ioon on pehmem hape kui Zn2+ ioon, siis reaktsioonil SCN- iooniga tekivad kompleksid, mis erinevad selle poolest, millise elemendi aatom on katiooniga seotud. Kuna lämmastik on kõvem alus kui väävel, siis soovib Zn2+ ühineda lämmastikuga ning Hg2+ ühineda väävliga.
TiCl4 + 2H2O → TiO2 + 4HCl
See hüdrolüüsireaktsioon on samuti kirjeldatav kõvade-pehmete hapete/aluste teooria põhjal. Titaan on pehmem hape kui vesinikioon, kloriid aga kõva alus, mistõttu kloriidioon moodustab palju hõlpsamini ühendi vesinikiooniga.
4Au + 8CN− + O2 + 2H2O → 4[Au(CN)2]− + 4OH−
Au + 4Cl− + NO3− + 4H+ → [AuCl4]− + NO + 2H2O
Kulla lahustumist saab vaadelda vastavalt HSAB teooriale kui happe-alus reaktsiooni. Esimese näite puhul moodustavad ühendi pehme hape Au ja pehme alus CN−.
CaS + CuO → CuS + CaO
4SiH3F → 3SiH4 + SiF4
Rekombinatsiooni reaktsiooni saab vaadata HSAB teooria alusel. Esimesel näitel on vask(II)ioon pehme hape ning kaltsium(II)ioon tugev hape, sulfiidioon on pehme alus ning oksiidioon kõva alus. Seega rekombineeruvad anioonid ja katioonid ringi nii, et kõva hape ühineb kõva alusega ja pehme hape pehme alusega. Teise näite puhul on räni kõva hape ning floriid ioon kõva alus, aga H− ioon on pehme alus. Seetõttu kombineeruvad ained nii, et saaksid ühineda kõva hape ja kõva alus.
Ühendite happelisust ja aluselisust ei ole paraku võimalik hästi kirjeldada tuginedes pelgalt ühele parameetrile. Selle puudujäägi korrigeerisid Russell S. Drago ja Bradford Wayland pakkudes välja poolempiirilise võrrandi, mis kirjeldab happe A ja aluse B vahelist reaktsiooni jaoks, mille entalpia on , on järgnev:[16][9]
,
kus parameeter võtab arvesse ühendi ioonseid interaktsioone ning parameter kovalentseid interaktsioone. Kasutades neid empiirilisi parameetreid on võimalik hinnata reaktsiooni tekkeentalpiat, kusjuures mõlema ühendi suured väärtused viitavad, et tegu on valdavalt kahe “kõva” ühendi reaktsiooniga ning ühendite suurte väärtuste korral pigem “nõrkade” ühendite reaktsiooniga. Võrrandi puuduseks on, et selle abil on võimalik hinnata ainult gaasifaasis või väheinterakteeruvates solventides toimuvaid reaktsioone, mistõttu saab seda kasutada peaasjalikult ainult neutraalsete molekulide korral.[6]
Viited
[muuda]- ↑ Voet, Judith G.; Voet, Donald. Biochemistry. New York: J. Wiley & Sons, 2004,pp. 496–500.
- ↑ Jiménez-Liso, M.R.; López-Banet, L.; Dillon, J. (2020).Changing How We Teach Acid-Base Chemistry. Sci & Educ 29, 1291–1315
- ↑ 3,0 3,1 Rayner-Canham, Geoffrey W., Geoff Rayner-Canham, and Tina Overton. Descriptive inorganic chemistry. Macmillan, 2003, pp. 137-160.
- ↑ Miessler, G.L.; Tarr, D.A. (1991). Inorganic Chemistry
- ↑ Germann, Albert F.O. (6 October 1925). "A General Theory of Solvent Systems". Journal of the American Chemical Society. 47 (10): 2461–2468.
- ↑ 6,0 6,1 6,2 6,3 6,4 6,5 6,6 6,7 Atkins, Peter, and Tina Overton. Shriver and Atkins' inorganic chemistry. Oxford University Press, USA, 2010, pp. 111-143.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. p. 1056.
- ↑ Fuentealba, P.; Cárdenas, C. (2014) Density functional theory of chemical reactivity. Chemical Modelling (11). p. 151-174.
- ↑ 9,0 9,1 9,2 9,3 Pfennig, Brian W. Principles of inorganic chemistry. John Wiley & Sons, 2015, pp. 455–467.
- ↑ Chermette, H. (1999). Chemical Reactivity Indexes in DensityFunctional Theory. Journal of Computational Chemistry (20). 129-154.
- ↑ Te Velde, G.; Bickelhaupt, F. M.; Baerends, E. J.; Fonseca Guerra, C.; van Gisbergen, S. J. A.; Snijders, J. G.; Ziegler, T. (2001) Chemistry with ADF. Journal of Computational Chemistry (22). p 931-967.
- ↑ Schmid, Roland, and Arzu M. Miah. The strength of the hydrohalic acids. Journal of Chemical Education 78.1 (2001): 116.
- ↑ Moran, Michael J.Factors that influence relative acid strength in water: A simple model. Journal of chemical education 83.5 (2006): 800.
- ↑ Meek, Terry L. Acidities of oxoacids: Correlation with charge distribution. Journal of chemical education 69.4 (1992): 270.
- ↑ https://docs.google.com/spreadsheets/d/1eEUuZLFTqfk_pBOIxkN_Ah91JAQTwh9y6VHOW_SpM7k/edit?usp=sharing
- ↑ Drago, R. S.; Wayland, B. B. (1965). A Double-Scale Equation for Correlating Enthalpies of Lewis Acid-Base Interactions. Journal of the American Chemical Society. 87: 3571–3577


![{\displaystyle \mathrm {Co^{2+}+6H_{2}O\rightleftharpoons Co[H_{2}O]_{6}^{2+}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c6053ab030ddfd0811564b83a9f403f1b7683ebf)


![{\displaystyle \mathrm {3AgNO_{3}+[Co(NH_{3})_{6}]Cl_{3}\rightleftharpoons 3AgCl+[Co(NH_{3})_{6}](NO_{3})_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/c14706c1aaed618fead32ccaed193db99c9d1af6)



![{\displaystyle K_{a}={\frac {{\ce {[H+] [A^-]}}}{{\ce {[HA]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af0c99ef7632ef0c682b59d74183d73d1ac9d9ef)
![{\displaystyle \mathrm {[A^{-}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/1de76ac3bc2f9c0bbdc78d549f07c69889af02e3)
![{\displaystyle \mathrm {[H^{+}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9ffd28eace83289203a5c1cde0d6974ba83251b2)
![{\displaystyle \mathrm {[HA]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/1e008124515a55b90a4f0df5a1aa52dd39d1e3ac)






![{\displaystyle pK_{a}=15,14-88,16[{\frac {Z^{2}}{r}}+0,096(\chi -1,50)]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0222ca04757337da23bce51e254d9aed8df361e8)


















































































