Anorgaaniline Keemia/Halogeniidid ja pseudohalogeniidid
Halogeniidid ja pseudohalogeniidid:struktuur ja omadused
Halogeniidid on binaarsed ühendid, mis sisaldavad halogeeni (, , , , ) ja sellest elektropositiivsemat elementi või radikaali. Halogeeni oksüdatsiooniaste on tavaliselt −I.
Struktuur
[muuda]Halogeniide saab struktuuri alusel jagada ioonilisteks, molekulaarseteks ja polümeerseteks. Ioonilised jagunevad monoaatomiliste ioonidega ühenditeks () ja molekulaarsete ioonidega ühenditeks (). Molekulaarsed on kas monomeersetest molekulidest (, , ,), oligomeeridest (E–X–E sidemega: ) või klastritest (E–E sidmega: , ). Polümeersed on näiteks ja .

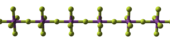

See, kas halogeniid on polümeerse, ioonilise või molekulaarse struktuuriga, oleneb vastava molekulaarse osakese happelisusest. Tänu elektronpaaride olemasolule saab halogeeniaatom käituda elektrontiheduse doonorina juhul, kui teise elemendi aatom on piisavalt happeline ning intermolekulaarne interaktsioon pole nt steeriliselt takistatud. Happelisus on tingitud sobiva sümmeetriaga tühja LUMO orbitaali olemasolust. Vaba ruum happelise aatomi ümber määrab maksimaalse doonor-aktseptor st koordinatiivsete sidemete arvu, ehk koordinatsioonilise küllastatuse. Koordinatiivselt küllastamata molekulide vahele tekivad koordinatiivsed sidemed halogeeni vabast elektronpaarist ja tsentraalaatomi vabast orbitaalist (tekivad M–X–M sillad). Ühe või kahe koordinatiivse sideme korral on ühend polümeer või oligomeer. Kui iga halogeen moodustab sideme, tekib lõputu polümeerne struktuur [1]. Molekulaarse halogeniidi koordinatiivne küllastamatus suureneb rühmas alla liikudes aatomiraadiuse kasvamise tõttu, ehk aatomi ümber on rohkem vaba ruumi. , ja on molekulaarsed (monomeerid), aga ja on oktaeedriliste tsentritega polümeerid. Perioodis vasakule liikudes kasvab koordinatiivne küllastamatus. Vabade orbitaalide arv ja vaba ruum tsentraalaatomi ümber suurenevad, mis on olulisemad kui tsentraalaatomi oksüdatsiooniastme vähenemise mõju (mis on trendile vastupidise suunaga). ja on molekulaarsed, aga on 3D polümeerse struktuuriga, kus koordinatsiooniarv on 6 [1].



Metallide oksüdatsiooniastme suurenemine põhjustab metall–halogeen sideme muutumise ioonilisest kovalentsemaks. Struktuur muutub o.a suurenedes 3D ioonilisest kristallist kihiliseks (nn 2D struktuur) või polümeerseks (1D struktuur), seejärel molekulidest koosnevaks tahkiseks (0D struktuur) [2], kuna o.a suurenemisel loomulikult väheneb halogeeni koordinatsiooniarv, mis vähendab struktuuri dimensioooni. Tabelis tähistavad ülaindeksid elemendi koordinatsiooniarvu. Näiteks , millele vastab , on molekulaarne ja koordinatsiooniarv on 1.
| E o.a +1, ainult 3D struktuurid võimalikud | E o.a +2, põhiliselt 2D ja 3D struktuurid | E o.a +4 alates molekulaarsed võimalikud. 3D vaid kõrge E koordinatsiooni korral. | |||||||
| 0D | - | - | - | - | - | - | - | ||
| 1D | - | - | - | - | - | - | ? | ||
| 2D | ? | - | - | * | - | ||||
| 3D | - | - | |||||||
Metallide halogeniidid valemiga ja tavaliselt 3D ioonilise struktuuriga, 1 ja 2 rühma metallidega moodustuvad tuntud ja tüüpi võred. asub tulbas sest ja koordinatsiooniarv võres on 6, st moodustab tahktsentreeritud kuubilise võre. asub tulbas, st moodustab ruumtsentreeritud kuubilise võre, milles ioonide koordinatsiooniarv on 8. Rutiili () võres on katiooni koordinatsiooniarv 6 ja anioonil 3.
Trifluoriidid on tavaliselt 3D võrega (), trihalogeniidid , või -ga moodustavad tavaliselt kihilisi struktuure. korral on juba võimalikud molekulaarsed struktuurid (, ), võivad moodustada ringe või ahelaid sildadega (), kõrge koordinatsiooniarvu korral on veel võimalik 3D struktuur (). on molekulaarsed () või sisaldavad ringe või ahelaid sildadega ().Valemiga on molekulaarsed oktaeedrilised (, ).[2]
Trendid d-metallide halogeniidides
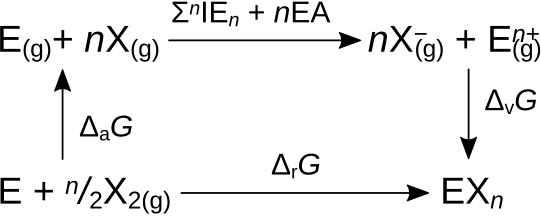
[muuda]d-metallide halogeniidide termodünaamiliste (ja mõnel juhul kineetiliste) andmete põhjal on võimalik iseloomustada mitmeid perioodilisuse tabelis esinevaid trende ja seaduspärasusi ning neid termodünaamilise tsükli abil analüüsida [3]. Halogeniidi tekkimise Gibbsi energia saab jagada mitmeks etapiks. Energiat kulutavad ja , kus arvestab metalli sublimeerumist ja halogeeniaatomite vahelise sideme lõhkumist ning halogeenimolekuli aurustamist ning on metalli ionisatsioonienergia summa. Energia eraldumisega on seotud EA ja , EA on halogeeni elektronafiinsus ja võre tekkimise energia. Energiat kulutavate ja energiat andvate protsesside vahekord määrab väärtuse.
Võreentalpiat (joonisel osa) kirjeldab Born-Lande' võrrand.
Kus on Borni eksponent, elementaarlaeng, ja katiooni ja aniooni laengud, on ioonraadiuste summa [1]. Kui võretüüp jääb samaks, siis saab eri halogeniidide võreentalpiaid võrrelda järgmise avaldise abil:
.
Sama valemi (st ) korral on halogeniidide tekkeentalpia negatiivsem kui tekke Gibbsi energia . Gibbsi energiat ja entalpiat seob võrrand . Erinevus esineb, sest halogeniidi tekkeraktsiooni ei võrdu nulliga. ja korral on erinevus suurem, sest need on standardtingimustel gaasilised ja gaasi sidumisega kaasneb suur negatiivne entroopiamuut. korral on erinevus väiksem ja korral veel väiksem, sest need on vastavalt vedelik ja tahkis [3].
Halogeniidi tekkeentalpia muutub vähem negatiivseks kui muutub reas , , , . Ühendi tekkimise termodünaamilises tsüklis jäävad halogeeni varieerides metalli puudutavad energiad (sublimatsioonienergia ja ioonisatsioonienergiad ()) samaks ning muutuvad osad võib jagada kaheks etapiks: halogeeniioonide tekkimine ja võreentalpia . Võreentalpia (ehk võre tekkel vabanev energia) muutub halogeeniaatomite suurenedes (ioonide suurenedes) vähem negatiivseks. Ja ka muutub positiivsemaks. Mõlemad toetavad trendi, aga võreentalpia muutub palju rohkem. korral , , , [3].
Kõrgete o.a-ga halogeniidide tekkeentalpia muutub metalli rühmas alla liikudes negatiivsemaks (st stabiilsemaks) ja madala o.a-ga positiivsemaks (n ja X konstantsed). 3d-metalli järjestikused ionisatsioonienergiad kasvavad kiiremini kui 4d ja 5d elementidel. Samas sublimatsioonientalpia kasvab rühmas alla liikudes ning on 3d elemendi ühendis negatiivsem kui 4d ja 5d ühendites (kuna 4d ja 5d ioonraadiused on suuremad kui 3d elemendi ioonraadius. ja soosivad 3d elemendi madalamat tekkeentalpiat. Ionisatsioonienergiate muutumise ja ( + ) vastukäiva efekti tõttu tekib muutus madalate ja kõrgete oksüdatsiooniastmetega ühendite tekkeentalpiate muutumise vahel. s-elektronide, ehk tavaliselt esimese ja teise ioonisatsioonienergia väärtused ei erine rühmas alla liikudes oluliselt ja tulemuse määrab ja koosmõju. Need väärtused on madalama raadiuse tõttu on väiksemad 3d elementide puhul, millede halogeniid on seetõttu negatiivsema tekkeentalpiaga. Edasised ionisatsioonienergiad on 3d metallidel 4d ja 5d metallidest oluliselt suuremad, seepärast on 4d ja 5d metallide kõrge o.a-ga ühendid madalamate tekeentalpiatega. Nendel põhjustel moodustavad 3d-metallid pigem madalama o.a-ga halogeniide ja 4d ning 5d metallid kõrgema o.a-ga halogeniide (vt kahte järgnevat seost) [3].
3d-elemendid ei moodusta nii kõrge o.a-ga halogeniide kui 5d-elemendid. Kõrge o.a-ga 3d elementide halogeniidid on suhteliselt ebastabiilsed, võrreldes vastavate 4d- ja 5d-elementide ühenditega, sest 3d ionisatsioonienergiad kasvavad oluliselt kiiremini ning negatiivsem võreentalpia ja väiksem sublimatsioonienergia ei ole piisavad, et tasakaalustada 3d elemendi ionisatsioonienergiate kasvamist. on stabiilne, aga hüpoteetiline ühend ei ole, sest erinevus ja 4. IE vahel on suur (4507 vs 3695 kJ/mol). Sublimatsioonientalpiad on ja . oleks stabiine lähteainete suhtes (), aga ei ole stabiilne ja ½ suhtes(vt ülejärgmine trend)[3].
3d-elemendid moodustavad madalama o.a-ga halogeniide kui 5d-elemendid. 4d- ja 5d-elementide suurem sublimatsioonienergia ja väiksem võreentalpia võrreldes 3d-elemendi ühendiga muudavad nende madala o.a-ga halogeniidid võrreldes vastava 3d-elemendi ühendiga ebastabiilsemateks [3].
Halogeniidi () tekkeentalpia muutub negatiivsemaks suurenedes. Seaduspära esineb, kuna vastasel korral oleks halogeniidi lagunemine eksotermiline. Ehk ebastabiilne madalama oksüdatsiooniastmega vormi suhtes. Laguneks madalama o.a-ga halogeniidiks ja halogeeniks [3].
Jood moodustab madalama o.a-ga haliide kui ja nii edasi halogeeni rühmas üles liikudes. Seaduspära võib ümber sõnastada küsimuseks, et miks on joodi vastav ühend ebastabiilne. Võrrelda fluoriide jodiididega , , ja näitel. on ebastabiilne, kuna laguneb -ks ja ½ -ks, on stabiilne. Üleminekute ja erinevused on joodi ja fluori ühendite võreentalpiates ja halogeniidiooni tekkeentalpiates. Fluoriidiooni tekkimine on eksotermilisem kui jodiidiooni tekkimine ja võreentalpia muutub korral rohkem (negatiivsemaks) kui korral. Mõlemad muudavad võrreldes -ga stabiilsemaks [3].
Halogeeni rühmas alla liikudes väheneb metalli oksüdatsiooniaste halogeniidis Trend esineb, kuna võreentalpia suureneb rohkem kui korral, mis soodustab korral disproportsioneerumist. on ebastabiilne disproportsioneerumise suhtes, aga ei ole. . Sama loogika seletab, miks on korral vastava halogeeni madalaima o.a-ga halogeniidid ja , korral ja , korral ja [3].
Pseudohalogeniidid
[muuda]Pseudohalogeenid (näiteks ) on mitmeaatomilised halogeenide analoogid, käituvad keemiliselt sarnaselt. Pseudohalogeniidioonideks nimetatakse halogeniidioonidega sarnaste omadustega ioone [4]. Mõned tuntumad on CN− tsüaniid, NCS− tiotsüanaat, NCO− tsüanaat, CNO− fulminaat, N3− asiid. Tuntud on ka kovalentsete p-elementide halogeniidide pseudohalogeniididest analooge. Sarnasusel on piirid, sest pseudohalogeniidioonid ei ole sfäärilised, mis viib iooniliste ühendite struktuuri erinemiseni [5].
Interhalogeniidid
[muuda]Interhalogeniidid on halogeenidevahelised ühendid, jagunevad binaarseteks, tertsiaarseteks ( ja ), ioonilisteks (, , ) ja polümeerseteks ioonideks (, , ). Binaarseid interhalogeniide on valemitega , , , , kus on -st elektronegatiivsem halogeen. Kõrgemad (n = 3, 5 ja 7) on ainult fluoriga võimalikud (erand ). ja struktuuri saab kirjeldada VSEPR mudeli abil, on murtud T kujulised ja on kas nelinurkse püramiidi või trigonaalse bipüramiidi kujulised. Ainsa ühendi kohta pole struktuur eksperimentaalset tõestatud [5]. Kõik binaarsed interhalogeenid on oksüdeerijad. kasutatakse fluoreeriva reagendina kuna reageerib paljude ühenditega -st kiiremini, kuigi on -st TD nõrgem floreerija, sest tekkeentalpia on negatiivne. Kasutatakse näiteks niklist aparatuuri passiveeriva fluoriidikihi loomiseks [5] ja tuumaenergeetikas saamiseks [2].
Viited
[muuda]- ↑ 1,0 1,1 1,2 Mingos, D.M.P. Essential Trends in Inorganic Chemistry, 1998, Oxford University Press, Oxford
- ↑ 2,0 2,1 2,2 Housecroft, Sharpe. Inorganic Chemistry, 2nd ed. 2005 Pearson Education Ltd, England
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 3,7 3,8 In Search of a Deep Understanding of the Relative Stabilities of Transition Metal Halides Journal of Chemical Education 2001 78 (12), 1635 DOI: 10.1021/ed078p1635
- ↑ IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Online version (2019-) created by S. J. Chalk. ISBN 0-9678550-9-8. https://doi.org/10.1351/goldbook.
- ↑ 5,0 5,1 5,2 Atkins, P.W.; Overton, T.L.; Rourke, J.P.; Weller, M.T. (2010). Shriver and Atkins' Inorganic Chemistry. New York: Oxford University Press.